АНАЛОГИ ПРОИЗВОДНОГО ФЕНАЗОНА, 4-АМИНОАНТИПИРИНА ПРОДЕМОНСТРИРОВАЛИ МОЩНУЮ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНТИОКСИДАНТНУЮ АКТИВНОСТЬ СРАВНИМУЮ С ДИКЛОФЕНАКОМ И АСКОРБИНОВОЙ КИСЛОТОЙ СООТВЕТСТВЕННО
Ключевые результаты
- Соединения не проявляли значительной цитотоксичности в отношении клеточных линий HeLa и MCF-7
- Продемонстрирована выраженная способность данных соединений связывать оксидоредуктазу, ЦОГ-1 и ЦОГ-2
Введение
В классе НПВП изомер гетероциклического лактама, содержащего кето-группу, пиразолон вызывает особый интерес со стороны исследователей. Обнаружены различные терапевтические эффекты его изомеров, в том числе обезболивающий, жаропонижающий [1], противовоспалительный [2], гипогликемический [3], антиоксидантный [4], антипролиферативный [5], противогрибковый и антимикробный [6].
Производное пиразолона, феназон, или антипирин – хорошо известное соединение, обладающее мощными обезболивающими и жаропонижающими свойствами, нашедший применение в медицине, в частности, в оториноларингологии. Так, феназон используется в составе местной терапии воспалительных заболеваний среднего уха. Его 4-аминопроизводное также проявляет противовоспалительный эффект.
Производные пиразолин-5-она, к которым относится феназон, известны как неселективные ингибиторы изоферментов ЦОГ, ингибирующие синтез тромбоксана и
простаноидов [7]. Изучены их антиоксидантные свойства.
Напомним, что активные формы кислорода, играющие важную роль в работе жизненно важных органов и систем, должны своевременно детоксицироваться. В противном случае развивается окислительный стресс, сопряженный с развитием таких заболеваний, как атеросклероз [8], сердечно-сосудистой патологией [9] и так далее.
Производное феназона, 4-аминоантипирин продемонстрировал высокие способности поглощать свободные пероксидные, гидроксильные, супероксидные радикалы, а также оксид азота и пероксинитрит [10].
В последние годы исследования сосредоточены на улучшении профиля безопасности и расширения спектра фармакологических эффектов классических противовоспалительных препаратов за счет модуляции их химического строения различными гетероциклическими структурами, в частности, тиазолами, триазолами, пиримидинами, тиофенами[11], [12]. Большой интерес вызывают гетероциклические соединения с 2-минотиофеновым кольцом. У ряда производных тиофена и тиенопиримидина обнаружены анальгетические, противовоспалительные, антидепрессивные, антиоксидантные, противовирусные, противоопухолевые и другие свойства [13].
По всей вероятности молекула, несущая несколько фармакофоров с разным механизмом действия может иметь потенциальную активность в отношении более чем одного заболевания. Qazi Yasar с соавт. [14] провели исследование, основной целью которого стала разработка и синтез новых производных антипирина с пиразольным фрагментом и 2-аминотеофенами, потенциально обладающими противовоспалительными свойствами.
Методы
Ход реакции контролировали методом тонкослойной хроматографии на силикагеле-G, предварительно покрытом алюминиевыми пластинами; визуализацию проводили в ультрафиолетовом свете.
Все соединения были синтезированы в результате реакции между 4-аминоантипирином и различными аминами. Все реакции контролировались с помощью тонкослойной хроматографии. Синтезированные аналоги 4-аминоантипирина тестировали на противовоспалительную активность in vitro при помощи пробы денатурации белков. В качестве стандартного препарата сравнения использовали диклофенак. Кроме того, проводили оценку антиоксидантной активности соединений с помощью 1,1-дифенил-1-пикрилгидразила и аскорбиновой кислоты в качестве стандартного препарата.
Исследование цитотоксичности основывали по росту клеток в клеточных линиях.
Результаты исследования
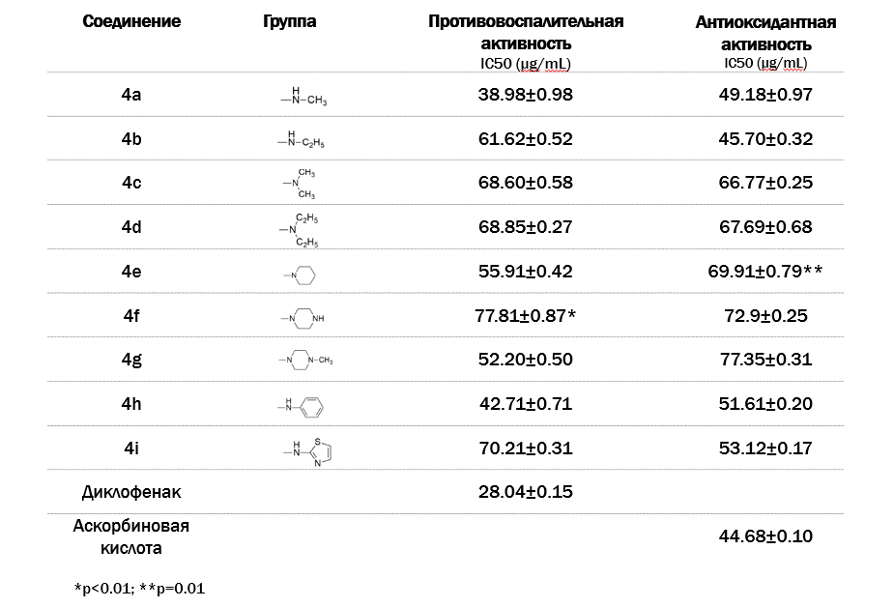
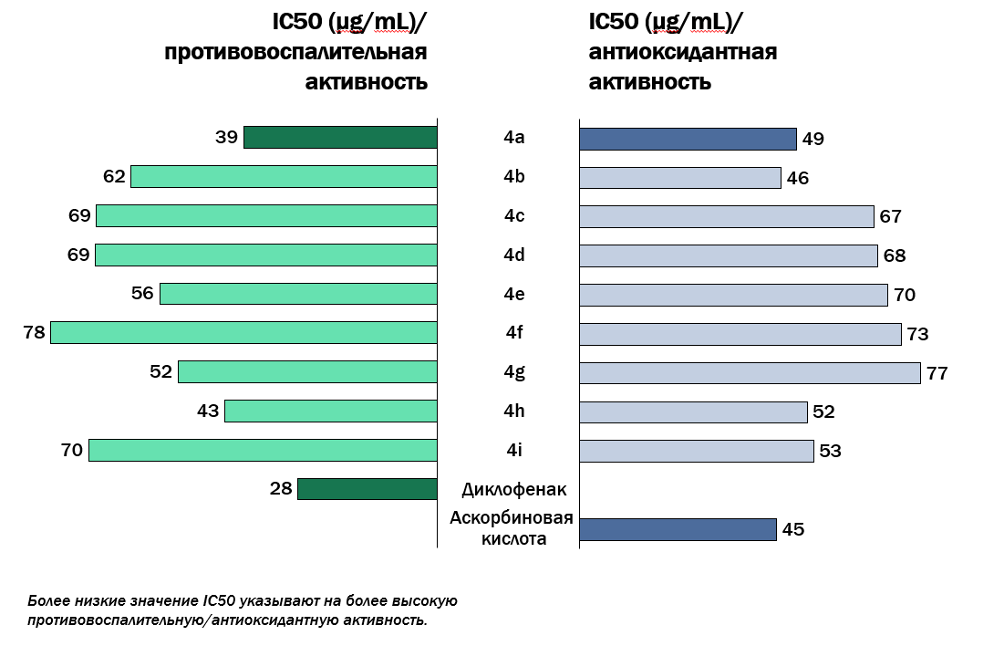
Результаты показали, что синтезированные соединения обладают выраженными противовоспалительными свойствами. Наиболее активным оказалось соединение, в структуре которого простая метильная группа была заменена на амин (4а). Соединения, содержащие пиперидиновое, N-метилпиперазиновое и анилиновое кольца также обладали мощным противовоспалительным эффектом (рис. 1,2).
Самым мощным антиоксидантом стало соединение, в котором этильная группа была замещена на амин (4b) (рис.1,2). Можно предположить, что именно эта группа ответственна за антиоксидантный эффект. В то же время способность связывать свободные радикалы также проявляли молекулы с метильной группой, анилиновым и тиазольным кольцами.
Исследования цитотоксичности показали, что наиболее активные соединения 4а и 4b не проявляют значительной клеточной цитотоксичности в отношении клеток HeLa и MCF7.
Рисунок 1. Противовоспалительная и антиоксидантная активность синтезированных производных (4а-i)
*p<0.01; **p=0.01
Рисунок 2. Противовоспалительная и антиоксидантная активность синтезированных производных (4а-i)
Заключение
Синтезированные производные противовоспалительного препарата феназона, связанные с 2-аминотиофеном, продемонстрировали в большинстве случаев выраженные противовоспалительные свойства (диапазон IC50 = 38.98-77.81μg/mL). Соединение 4а показало наиболее высокую активность по сравнению с диклофенаком, соединение 4b продемонстрировало самые выраженные антиоксидантные свойства по сравнению с аскорбиновой кислотой. Исследование цитотоксичности показало, что наиболее сильнодействующие соединения 4a и 4b не проявляют какую-либо значимую цитотоксичность в отношении клеточных линий MCF7 и HeLa.
Таким образом, производные феназона могут быть оптимизированы и изучены дополнительно в качестве перспективных молекул с выраженными терапевтическими свойствами и хорошей переносимостью.
Использованные источники
[1] S. A. M. El-Hawash, E. S. A. M. Badawey, and I. M. El-Ashmawey, “Nonsteroidal antiinflammatory agents—part 2 antiinflammatory, analgesic and antipyretic activity of some substituted 3-pyrazolin-5-ones and 1,2,4,5,6,7-3H-hexahydroindazol-3-ones,” Eur. J. Med. Chem., vol. 41, no. 2, pp. 155–165, Feb. 2006, doi: 10.1016/J.EJMECH.2005.09.006.
[2] M. A. A. El-Sayed, N. I. Abdel-Aziz, A. A. M. Abdel-Aziz, A. S. El-Azab, and K. E. H. Eltahir, “Synthesis, biological evaluation and molecular modeling study of pyrazole and pyrazoline derivatives as selective COX-2 inhibitors and anti-inflammatory agents. Part 2,” Bioorg. Med. Chem., vol. 20, no. 10, pp. 3306–3316, May 2012, doi: 10.1016/J.BMC.2012.03.044.
[3] N. Fushimi et al., “Structure–activity relationship studies of 4-benzyl-1H-pyrazol-3-yl β-d-glucopyranoside derivatives as potent and selective sodium glucose co-transporter 1 (SGLT1) inhibitors with therapeutic activity on postprandial hyperglycemia,” Bioorg. Med. Chem., vol. 20, no. 22, pp. 6598–6612, Nov. 2012, doi: 10.1016/J.BMC.2012.09.037.
[4] N. A. Khalil, E. M. Ahmed, H. B. El-Nassan, O. K. Ahmed, and A. M. Al-Abd, “Synthesis and biological evaluation of novel pyrazoline derivatives as anti-inflammatory and antioxidant agents,” Arch. Pharmacal Res. 2012 356, vol. 35, no. 6, pp. 995–1002, Jun. 2012, doi: 10.1007/S12272-012-0606-9.
[5] Shamsuzzaman, H. Khanam, A. Mashrai, A. Sherwani, M. Owais, and N. Siddiqui, “Synthesis and anti-tumor evaluation of B-ring substituted steroidal pyrazoline derivatives,” Steroids, vol. 78, no. 12–13, pp. 1263–1272, 2013, doi: 10.1016/J.STEROIDS.2013.09.006.
[6] S. Y. Hassan, “Synthesis, Antibacterial and Antifungal Activity of Some New Pyrazoline and Pyrazole Derivatives,” Mol. 2013, Vol. 18, Pages 2683-2711, vol. 18, no. 3, pp. 2683–2711, Feb. 2013, doi: 10.3390/MOLECULES18032683.
[7] F. Mahle et al., “Synthesis and biological evaluation of N-antipyrine-4-substituted amino-3-chloromaleimide derivatives,” Eur. J. Med. Chem., vol. 45, no. 11, pp. 4761–4768, Nov. 2010, doi: 10.1016/J.EJMECH.2010.07.040.
[8] K. F. Gey, “Prospects for the prevention of free radical disease, regarding cancer and cardiovascular disease,” Br. Med. Bull., vol. 49, no. 3, pp. 679–699, 1993, doi: 10.1093/OXFORDJOURNALS.BMB.A072640.
[9] D. P. Vivekananthan, M. S. Penn, S. K. Sapp, A. Hsu, and E. J. Topol, “Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials,” Lancet, vol. 361, no. 9374, pp. 2017–2023, Jun. 2003, doi: 10.1016/S0140-6736(03)13637-9.
[10] G. Mariappan, B. P. Saha, N. R. Bhuyan, P. R. Bharti, and D. Kumar, “EVALUATION OF ANTIOXIDANT POTENTIAL OF PYRAZOLONE DERIVATIVES,” J. Adv. Pharm. Technol. Res., vol. 1, no. 2, p. 260, Apr. 2010, Accessed: Jul. 25, 2022. [Online]. Available: /pmc/articles/PMC3255439/
[11] H. Bayrak, A. Demirbas, N. Demirbas, and S. A. Karaoglu, “Cyclization of some carbothioamide derivatives containing antipyrine and triazole moieties and investigation of their antimicrobial activities,” Eur. J. Med. Chem., vol. 45, no. 11, pp. 4726–4732, Nov. 2010, doi: 10.1016/J.EJMECH.2010.07.018.
[12] S. A. F. Rostom, I. M. El-Ashmawy, H. A. Abd El Razik, M. H. Badr, and H. M. A. Ashour, “Design and synthesis of some thiazolyl and thiadiazolyl derivatives of antipyrine as potential non-acidic anti-inflammatory, analgesic and antimicrobial agents,” Bioorg. Med. Chem., vol. 17, no. 2, pp. 882–895, Jan. 2009, doi: 10.1016/J.BMC.2008.11.035.
[13] Synthesis and Antioxidant Activity of Ethyl 2-Amino-6-cyano-6-phenyl-4,5,6,7-tetrahydro-1-benzothiophene-3-carboxylates and 3-Amino-4-oxo-7-phenyl-3,4,5,6,7,8-hexahydrobenzo[4,5]thieno[2,3-d]pyrimidine-7-carbonitriles.” https://web.s.ebscohost.com/abstract (accessed Jul. 25, 2022).
[14] 4-Aminoantipyrine Analogs as Anti-inflammatory and Antioxidant agents: Synthesis, Biological Evaluation and Molecular Docking Studies.” https://web.s.ebscohost.com/abstract (accessed Jul. 25, 2022).