Ключевая информация
- Сурфактантный белок D (СБ-D), принадлежащий к семейству лектинов С-типа, играет важную роль в развитии иммунного ответа.
- По всей вероятности, дефицит СБ-D может быть одним из звеньев патогенеза острого отита.
Введение
Острый отит – лидирующая причина бактериальных инфекций и назначений антибиотиков в раннем детстве [1]. Около 60–80% детей испытывают как минимум один эпизод заболевания в течение первого года жизни [2]. Глобальное бремя острого отита также велико: в год регистрируется около 709 млн случаев во всем мире, причем у 31 млн детей инфекция приобретает хроническое течение [3], сопряженное со снижением слуха и другими осложнениями.
Этиология острого отита имеет как вирусное, так и бактериальное происхождение. Один из самых частых патогенов, связанных с заболеванием, – нетипичная Haemophilus influenzae (НТHi) [4].
Неосложненный острый отит обычно разрешается в течение нескольких дней даже без антибиотикотерапии. В течение этого периода формируется специфический иммунитет, играющий важную роль в разрешении инфекции. Он задействует врожденную иммунную систему, которая активируется без предварительной сенсибилизации. При отсутствии специфических противомикробных антител СБ-D функционирует в первой линии защиты как рецептор опознавания паттерна, способный узнавать стандартные молекулярные структуры, специфичные для больших групп патогенов, в том числе наиболее распространенных возбудителей острого среднего отита – Streptococcus pneumoniae и H. influenzae.
Важным цитокином, запускающим воспалительный и антибактериальный ответ, является интерлейкин- 1β, который вырабатывается при активации каспазы-1. Ее предшественник, проскаспаза-1 входит в состав инфламмасомы NLRP3, которая индуцируется различными воспалительными стимулами посредством toll-подобных рецепторов и транскрипционного фактора NF-kB.
Методы
В исследовании, проведенном американскими учеными под руководством Osama Abdel-Razek [5], была использована модель острого отита, индуцированного НТHi, у генетически модифицированных мышей для изучения роли СБ-D и связанных с ним клеточных и молекулярных механизмов в патогенезе среднего отита.
Ученые использовали иммунофлуоресцентное окрашивание для изучения экспрессии СБ-D в слизистых оболочках среднего уха и евстахиевой трубы у мышей дикого типа и мышей с дефицитом СБ-D.
Результаты исследования
Результаты показали, что СБ-D экспрессируется в слизистой оболочке среднего уха и евстахиевой трубы у мышей дикого типа, что подтверждает уже опубликованные данные [6].
В ходе исследования было обнаружено, что отсутствие СБ-D может приводить к увеличению выраженности воспалительной реакции при НТHi-индуцированной инфекции среднего уха и пролонгировать разрешение заболевания по сравнению с мышами дикого типа.
СБ-D предотвращает распространение микробов за счет агглютинации и ингибирования роста, а также гибели бактерий. Он также взаимодействует с другими рецепторами распознавания паттерна, что приводит к усилению фагоцитоза и регуляции иммунного ответа.
Ученые оценивали влияние СБ-D на разные звенья иммунного ответа.
Отметим основные результаты.
- Более интенсивный и пролонгированный воспалительный ответ на инфекцию НТHi у мышей с дефицитом СБ-D по сравнению с диким типом мышей – в первой группе мышей была отмечена более утолщенная слизистая оболочка среднего уха, сопряженная с интенсивным иммунным ответом, по сравнению с мышами второй группы (p<0,05), а также более выраженная клеточная инфильтрация. К 7-му дню воспалительные изменения у мышей первой группы также были более выраженными по сравнению с мышами дикого типа.
- Более интенсивное восстановление уровня нейтрофилов и макрофагов у мышей дикого типа по сравнению с мышами с дефицитом СБ-D: на третьи сутки инфекции содержание макрофагов у мышей с дефицитом белка составило 3,4% от тотального количества клеток, а у мышей дикого типа – 7%. На 10-е сутки этот показатель составлял 23% и 38% соответственно.
- Значительная разница в количестве КОЕ[1] между мышами дикого типа и с дефицитом СБ-D на третьи сутки – в первом случае существенно меньшее количество (p< 0,05).
- Усиленная агрегация бактерий в присутствии СБ-D.
- Усиленный фагоцитоз макрофагами в присутствии СБ-D (рис. 1).
- Повышенный уровень провоспалительных цитокинов у мышей с дефицитом СБ-D по сравнению с мышами дикого типа.
- Повышенный уровень активации транскрипционного фактора NF-kB, контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла, у мышей с дефицитом СБ-D по сравнению с мышами дикого типа (рис. 2).
- Более высокая активация NLRP3 у инфицированных мышей с дефицитом СБ-D по сравнению с инфицированными мышами дикого типа. Это приводит к активации прокаспазы-1, расцепляющей проинтерлейкин-1β до активной формы.
Рисунок 1. СБ-D-опосредованный усиленный бактериальный фагоцитоз
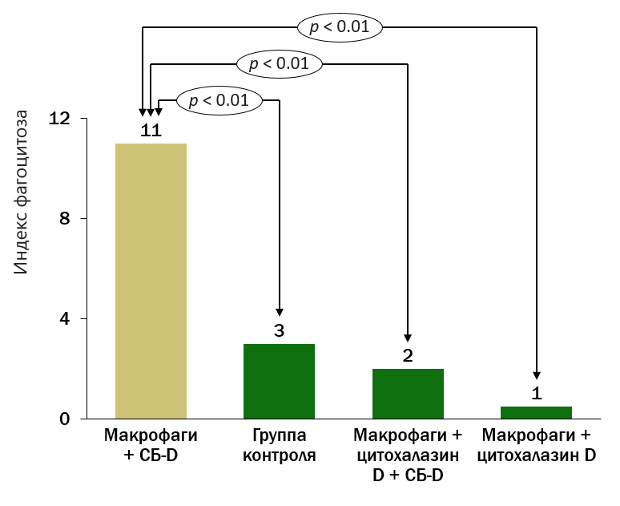
Исследование проводили с участием альвеолярных макрофагов, полученных из бронхоальвеолярного лаважа мышей с дефицитом СБ-D. Эксперименты проводились с четырьмя группами: только макрофаги (контроль), макрофаги плюс СБ-D, макрофаги плюс цитохалазин D, макрофаги плюс СБ-D плюс цитохалазин D.
Рисунок 2. Повышенная активация NF-kB у мышей с дефицитом СБ-D по сравнению с мышами дикого типа
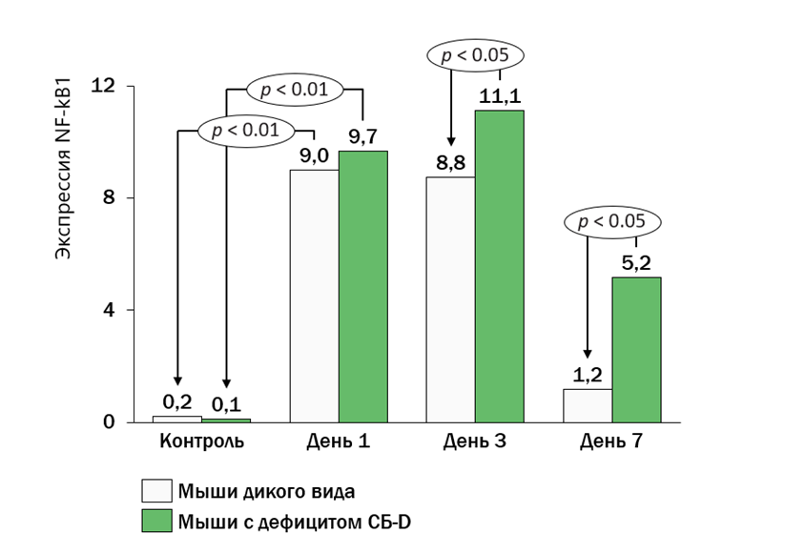
Результаты исследования показали, что СБ-D взаимодействует непосредственно с рядом бактерий, включая Pseudomonas aeruginosa, S.pneumoniae, Escherichia coli и Mycobacterium tuberculosis, что сопряжено с агглютинацией, фагоцитозом и активацией ингибирования [7]. Белок значительно индуцирует агрегацию бактерий NTHi и усиливает бактериальный фагоцитоз макрофагами.
Заключение
Таким образом, результаты исследования позволили сделать вывод о критической роли СБ-D во врожденном иммунитете за счет регуляции воспалительной NF-kB и NLRP3 активации у мышей с острым отитом.
Использованные источники
[1] A. Qureishi, Y. Lee, K. Belfield, J. P. Birchall, and M. Daniel, “Update on otitis media – prevention and treatment,” Infect. Drug Resist., vol. 7, p. 15, Jan. 2014, doi: 10.2147/IDR.S39637.[2] M. M. Pettigrew et al., “Association of surfactant protein A polymorphisms with otitis media in infants at risk for asthma,” BMC Med. Genet., vol. 7, no. 1, pp. 1–9, Aug. 2006, doi: 10.1186/1471-2350-7-68/TABLES/4.
[3] L. Monasta et al., “Burden of Disease Caused by Otitis Media: Systematic Review and Global Estimates,” PLoS One, vol. 7, no. 4, p. e36226, Apr. 2012, doi: 10.1371/JOURNAL.PONE.0036226.
[4] E. Leibovitz et al., “Epidemiologic and microbiologic characteristics of culture-positive spontaneous otorrhea in children with acute otitis media,” Pediatr. Infect. Dis. J., vol. 28, no. 5, pp. 381–384, 2009, doi: 10.1097/INF.0B013E318194E783.
[5] O. Abdel-Razek, T. Liu, X. Chen, Q. Wang, G. Vanga, and G. Wang, “Role of Surfactant Protein D in Experimental Otitis Media,” J. Innate Immun., vol. 13, no. 4, pp. 197–210, Sep. 2021, doi: 10.1159/000513605.
[6] O. Abdel-Razek, L. Ni, F. Yang, and G. Wang, “Innate immunity of surfactant protein A in experimental otitis media,” Innate Immun., vol. 25, no. 7, pp. 391–400, Oct. 2019, doi: 10.1177/1753425919866006.
[7] K. A. Soltysiak, E. J. Van Schaik, and J. E. Samuel, “Surfactant Protein D Binds to Coxiella burnetii and Results in a Decrease in Interactions with Murine Alveolar Macrophages,” PLoS One, vol. 10, no. 9, p. e0136699, Sep. 2015, doi: 10.1371/JOURNAL.PONE.0136699.